
23
ПИЩЕВАЯ ПРОМЫШЛЕННОСТЬ
7/2012
COMPLEX USAGE OF RAW MATERIALS
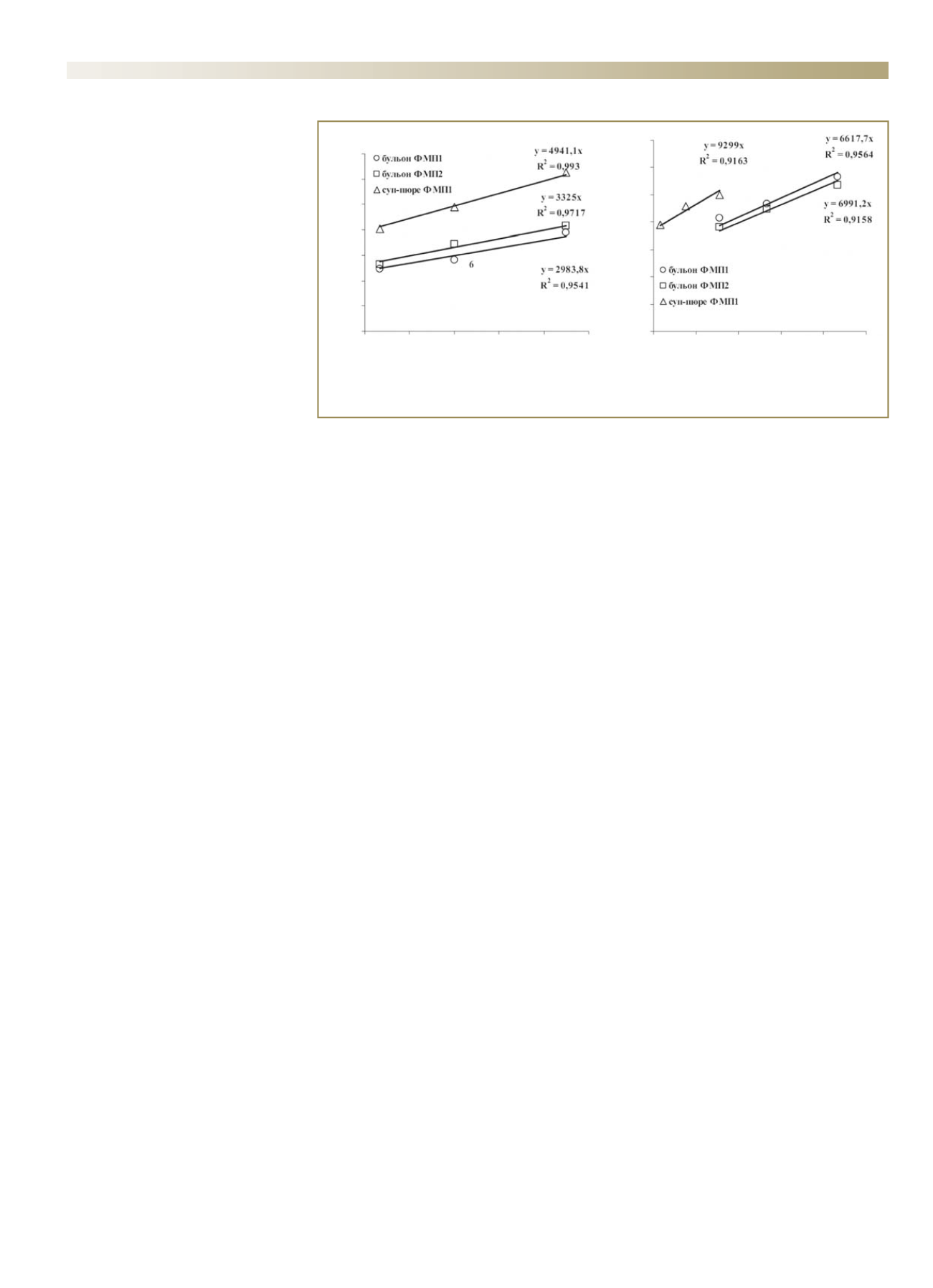
ке бульонов и супа&пюре разводили
50 мм фосфатно&солевым буфером,
рН 7,40 (ФСБ) в 60–90 раз и 90–120
раз соответственно. В указанных ди&
апазонах разведений зависимость
АОЕ от величины, обратной фактору
разбавления, с высоким коэффици&
ентом детерминации (R
2
>0,91) апп&
роксимировалась линейной функци&
ей (рис. 1).
Для экстракции липофильной
фракции 6 г продукта перемешивали
на Rotamix (Elmi, Литва) со скорос&
тью 90 мин
–1
с 50 мл смеси гексан&
хлороформ 1/1 (об./об.) в течение 2 ч
(Elmi, Lithuania). Экстракт высушива&
ли в потоке азота при 30°С. Для оп&
ределения АОЕ по отношению к пе&
роксильному радикалу маслянистый
остаток перерастворяли в 4 мл смеси
ацетон&вода (1:1 об./об.), содержа&
щей 7 % метил&b&циклодекстрина
(МЦД). Перед проведением анализа
фракцию дополнительно разводили
вышеуказанным раствором в 400–
600 раз.
Анализ АОЕ продуктов по отноше&
нию к катион&радикалу АБТС (TEAC).
Катион&радикал АБТС получали по
методу Re и соавт. [10]. Полученный
концентрированный раствор катион&
радикала АБТС разводили 50 мм
фосфатно&солевым буфером, pH
7,40 (ФСБ) до оптической плотности
(ОП) при 734 нм 0,70±0,02. В каче&
стве стандартного антиоксиданта ис&
пользовали водорастворимый ана&
лог витамина Е – тролокс. Для опре&
деления АОЕ в лунки 96&луночных
несорбирующих полистирольных
микропланшетов с плоским дном
вносили по 20 мкл исследуемых об&
разцов или раствора тролокса в ФСБ
и 180 мкл раствора катион&радикала
АБТС. В контрольные лунки вносили
20 мкл ФСБ и 180 мкл раствора кати&
он&радикала АБТС. Реакцию регист&
рировали по убыли ОП
734
в течение
40,5 мин с интервалом измерений
каждые 60 с при температуре 25 °С на
фотометре&флуориметре Synergy 2
(BioTek, США). Для каждой концент&
рации стандарта и исследуемого об&
разца измерения проводились в че&
тырех повторностях. При построении
калибровочной кривой зависимости
убыли оптической плотности от кон&
центрации тролокса его концентра&
цию в реакционной среде варьирова&
ли в пределах 1–10 мкМ. По убыли
оптической плотности реакционной
среды в присутствии исследуемых со&
единений определяли эквивалентные
концентрации антиоксидантов в про&
бе. АОЕ исследуемых продуктов вы&
ражали в микромолях эквивалентов
тролокса (ТЭ) в расчете на 1 г.
Анализ антиоксидантных свойств
продуктов по отношению к перок&
сильному радикалу (ORAC).
Анализ
проводили по методу Ou с соавт. в
модификации Moore c соавт. [9,10].
Пероксильный радикал генерирова&
ли непосредственно в реакционной
среде при термическом распаде азо&
соединения 2,2’&азобис (2&иетил&
пропионамидина) дигидрохлорида
(ААРН), инициируемом инкубацией
при 37 °С в течение 10 мин согласно.
При анализе АОЕ гидрофильной
фракции исследуемых продуктов ре&
акционная смесь содержала 15 мкл
раствора исследуемого продукта или
стандарта (тролокса) в 75 мм Na&
фосфатном буфере, рН 7,40 и 115
мкл 8,16х10
&8
М свежеприготовлен&
ного раствора флуоресцеината на&
трия в 75 мм Na&фосфатном буфере,
рН 7,40. При определении АОЕ гид&
рофильной фракции бульонов и су&
пов были использованы три вариан&
та контролей. В лунки с 0 % интен&
сивности флуоресценции (К1) вноси&
ли 130 мкл 75 мм Na&фосфатного бу&
фера, рН 7,40, в лунки со 100 % ин&
тенсивности флуоресценции (К2) –
30 мкл75 мм Na&фосфатного буфе&
ра, рН 7,40 и 115 мкл раствора флуо&
ресцеината натрия, в контрольные
лунки (К3) – 15 мкл75 мм Na&фос&
фатного буфера, рН 7,40 и 115 мкл
раствора флуоресцеината натрия.
При анализе АОЕ липофильной
фракции продуктов реакционная
смесь содержала 15 мкл раствора эк&
стракта исследуемого продукта или
стандарта (тролокса) в смеси аце&
тон&вода 1/1 (об./об.) с добавлени&
ем 7 % МЦД и 115 мкл 8,16х10
&8
М
свежеприготовленного раствора
флуоресцеината натрия в 75 мм Na&
фосфатном буфере, рН 7,40. В конт&
роль К1 вносили 15 мкл раствора
МЦД и 115 мкл 75 мм Na&фосфатного
буфера, рН 7,40; в контроль К2 – по
15 мкл раствора МЦД и75 мм Na&
фосфатного буфера, рН 7,40 и 115
мкл раствора флуоресцеината на&
трия; в контроль К3 – 15 мкл раство&
ра МЦД и 115 мкл раствора флуорес&
цеината натрия. При анализе АОЕ
гидрофильной и липофильной
фракций продуктов по отношению к
пероксильному радикалу реакцию
инициировали добавлением 15 мкл
свежеприготовленного 0,6 М ра&
створа ААРН в 75 мм Na&фосфатном
буфере рН 7,4 во всех вариантах,
кроме К2. Реакционную смесь инку&
бировали при температуре 37 °С в
течение 30 с при интенсивном пере&
мешивании (скорость вращения
1200 мин
–1
) на микропланшетном
термошейкере&инкубаторе PHMP
Grant Bio (Великобритания). Кинети&
ку убыли флуоресценции регистри&
ровали в течение 1 ч с интервалом
измерений 60 с при температуре
37 °С на фотометре&флуориметре
Synergy 2 (BioTek, США) в режиме
регистрации интенсивности флуо&
ресценции (длина волны возбужде&
ния – 485 нм, длина волны испуска&
ния – 528 нм). Величину АОЕ про&
дукта рассчитывали исходя из урав&
нения линейной регрессии между
концентрацией тролокса и приве&
денной площадью под кривой убыли
относительной интенсивности флуо&
ресценции флуоресцеина и выража&
ли в мкмоль ТЭ на 1 г.
Определение переваримости про&
дуктов пепсином in vitro.
Анализ пере&
варимости сухих пищевых бульонов и
супа проводили согласно действую&
щим отечественным и международ&
ным стандартам – ГОСТ Р51423–99
(ИСО 6655) и AOAC971.09.
Анализ гипотензивной активности
продуктов по ингибированию ангио&
тензин&I&превращающего фермента
(АПФ).
Анализ гипотензивной ак&
тивности продуктов проводили спек&
трофлуориметрическим методом
[14] c использованием АПФ из ткани
легкого кролика (Sigma, А6778,
США) и трифторацетата о&амино&
0,008 0,009 0,01 0,011 0,012 0,013
0,008 0,009 0,01 0,011 0,012 0,013
1/разведение
а
1/разведение
б
АОЕ, мкМТЭ
70
60
50
40
30
20
10
0
АОЕ, мкМТЭ
140
120
100
80
60
40
20
0
Рис. 1. Зависимость антиоксидантной емкости по отношению к пероксильному радикалу (а) и катион&
радикалу АБТС (б) от разведения гидрофильной фракции продуктов на основе ФМП1 и ФМП2
Электронная Науч ая СельскоХозяйственная Библиотека









