
В
иноделие
и
иноградарство
5/2011
34
виноградарство
ты и 550 мг/л цефотаксима, но в этих вари-
антах наблюдалась низкая приживаемость
растений.
Растения с нормальными листьями были
менее инфицированными. Приживаемость
растений в контроле после микрочерен-
кования оказалась выше, чем у расте-
ний с шиповатыми листьями (в 3,5 раза).
Салициловая кислота и цефотаксим и в
этом случае оказали положительное влия-
ние на приживаемость микрочеренков,
которая под их воздействием возросла
1,7–1,8 раза. И только при концентрации
цефотаксима 550 мг/л она была ниже, чем
в контроле. Однако улучшение приживае-
мости сопровождалось ингибированием
ростовых процессов растений. Менее все-
го растения были угнетены при содержании
салициловой кислоты 0,14 мг/л. При доста-
точно высокой приживаемости (78,5%) рас-
тения по длине корней и ризогенной зоны,
высоте, скорости роста приближались к
растениям контроля, а по облиственности
даже превосходили их. Во всех остальных
вариантах наблюдалось ингибирование
растений: наиболее существенное при
наличии 14 мг/л салициловой кислоты и
550 мг/л цефотаксима при культивирова-
нии в течение 30 и 45 сут.
При повторном субкультивировании
це-
фотаксим также положительно повлиял на
приживаемость микрочеренков, которая
в сравнении с контролем увеличилась на
14,2–17,2%. Кроме того, под влиянием
антибиотика увеличилось число корней,
но уменьшилась их длина (табл. 6, данные
2011 г.).
Наибольшее увеличение корней и ризо-
генной зоны отмечено при концентрации
цефотаксима 350–450 мг/л. Цефотаксим
(за исключением концентрации 550 мг/л)
также оказал положительное влияние на
рост побегов и их облиственность, скорость
роста. При повторном субкультивировании
не обнаружены растения с шиповатыми ли-
стьями, что служит косвенным показателем
оздоровления растений.
Последующие микрочеренкования про-
водили на питательных средах с добавле-
нием антибиотика
цефотаксим
, что способ-
ствовало улучшению ростовых процессов и
показателей развития растений.
Процесс оздоровления и микроразм-
ножения провели в очень краткий срок
(190
сут).
Это можно объяснить сортовыми
особенностями, летним (июльским) сроком
изолирования меристем и ввода их в куль-
туру, применением при культивировании
салициловой кислоты и антибиотика
цефо-
таксим
.
Выводы.
Введение в состав питательной
среды антибиотика
цефотаксим
оказывает
положительное влияние на регенерацию
меристем на этапе ввода и последующих
этапах пролиферации и ризогенеза, способ-
ствуя дополнительному оздоровлению расте-
ний. Салициловая кислота также дополняет
оздоровление апикальными меристемами:
у регенерированных растений уменьшается
число листьев со скрученными, шиповатыми
листьями и число растений с тонкими кор-
нями.
Введение салициловой кислоты и анти-
биотика
цефотаксим
в питательную среду
при первом субкультивировании на этапе
микрочеренкования способствовало по-
вышению приживаемости микрочеренков
в 1,7–7,0 раза в зависимости от состояния
маточных растений. Лучшая приживаемость
отмечена при содержании 1,4–14 мг/л са-
лициловой кислоты или 250–450 мг/л це-
фотаксима. Однако во всех этих вариантах
опыта отмечено ингибирующее действие
обоих препаратов на растения. Для преодо-
ления этих негативных явлений при втором
субкультивировании также добавляли в
питательную среду
цефотаксим
. При этом
выявлено его положительное влияние на
приживаемость микрочеренков и улучшение
качественных характеристик растений (уве-
личение числа корней и длины ризогенной
зоны, роста побегов и их облиственности).
При повторном субкультивировании не об-
наружены растения с шиповатыми листьями,
что служит косвенным показателем оздо-
ровления растений.
Биологическое тестирование на травяни-
стом индикаторе показало отсутствие хрони-
ческих болезней. Растения после адаптации
к нестерильным условиям были высажены
в виде вегетирующих саженцев с закрытой
корневой системой на базисном маточнике.
Следует отметить высокую приживаемость
оздоровленных растений в условиях от-
крытого грунта, хороший рост и адаптацию
растений к неблагоприятным погодным
условиям.
Список литературы
1.
Алиев, А.М.
Происхождение донских сортов
винограда [Текст]/А.М. Алиев, Л.В. Кравченко,
Л.Г. Наумова//Виноделие и виноградарство.
2005. №3. С. 27–29.
2.
Наумова, Л.Г.
Донские аборигенные сорта
винограда [Текст]/Л.Г. Наумова, А.М. Алиев
//Мобилизация и сохранение генетических ресур-
сов винограда, совершенствование методов
селекционного процесса: сб. науч. ст. ВНИИВиВ
им. Я. И. Потапенко. Новочеркасск: Изд-во
ВНИИВиВ им. Я.И. Потапенко, 2008. С. 19–23.
3.
Безрукова, М.
Салициловая кислота — регуля-
тор роста, обладающий антистрессовой актив-
ностью в растениях пшеницы/М. Безрукова,
А.Сахабутдинова,Д.Фатхутдинова,Ф.Шакирова//
Тезисы докл. 6‑й Межд. науч. конф. «Регуляторы
роста и развития растений в биотехнологиях».
26–28 июля 2001 г. М.: 2001. С. 11.
4.
Красавина, М.С.
Может ли салициловая кислота
влиять на межклеточный транспорт вируса табач-
ной мозаики через изменение проводимости
плазмодесм/М.С. Красавина, С.И. Малышенко,
Г.Н.Ралдигина,Н.А.Бурмистрова,А.В.Носов//Фи-
зиология растений. 2002. Т. 49. №1. С. 71–77.
5.
Упадышев, М.Т.
Аспекты оздоровления и размно-
жения ягодных и плодовых культур с использо-
ванием фенольных соединений/М.Т. Упадышев,
А.Д. Петрова//Сб. науч. работ «Плодоводство и
ягодоводство России». М.: 1998. Т. 5. С. 44–49.
6.
Петрова, А. Д.
Хемотерапия и размноже-
ние садовых культур на питательных средах с
фенолкарбоновыми кислотами/А.Д. Петрова,
М.Т. Упадышев//Сб. науч. работ «Плодоводство и
ягодоводство России». М., 2000. Т. 7. С. 67–72.
7.
Дорошенко, Н. П.
Применение салициловой
кислоты на этапе ввода в культуру
in vitro
под-
войных сортов винограда/Н.П. Дорошенко//Мо-
билизация и сохранение генетических ресурсов
винограда, совершенствование методов селек-
ционного процесса: мат. Межд. научно-практ.
конф. 13–14 августа 2008 г. Новочеркасск, 2008.
С. 162–167.
8.
Данилова, С.А.
Стимуляция регенерации рас-
тений в культуре тканей кукурузы под действи-
ем антибиотика цефотаксима/С.А. Данилова,
Ю.И. Долгих//Физиология растений. 2004. Т. 51.
№4. С. 621–623.
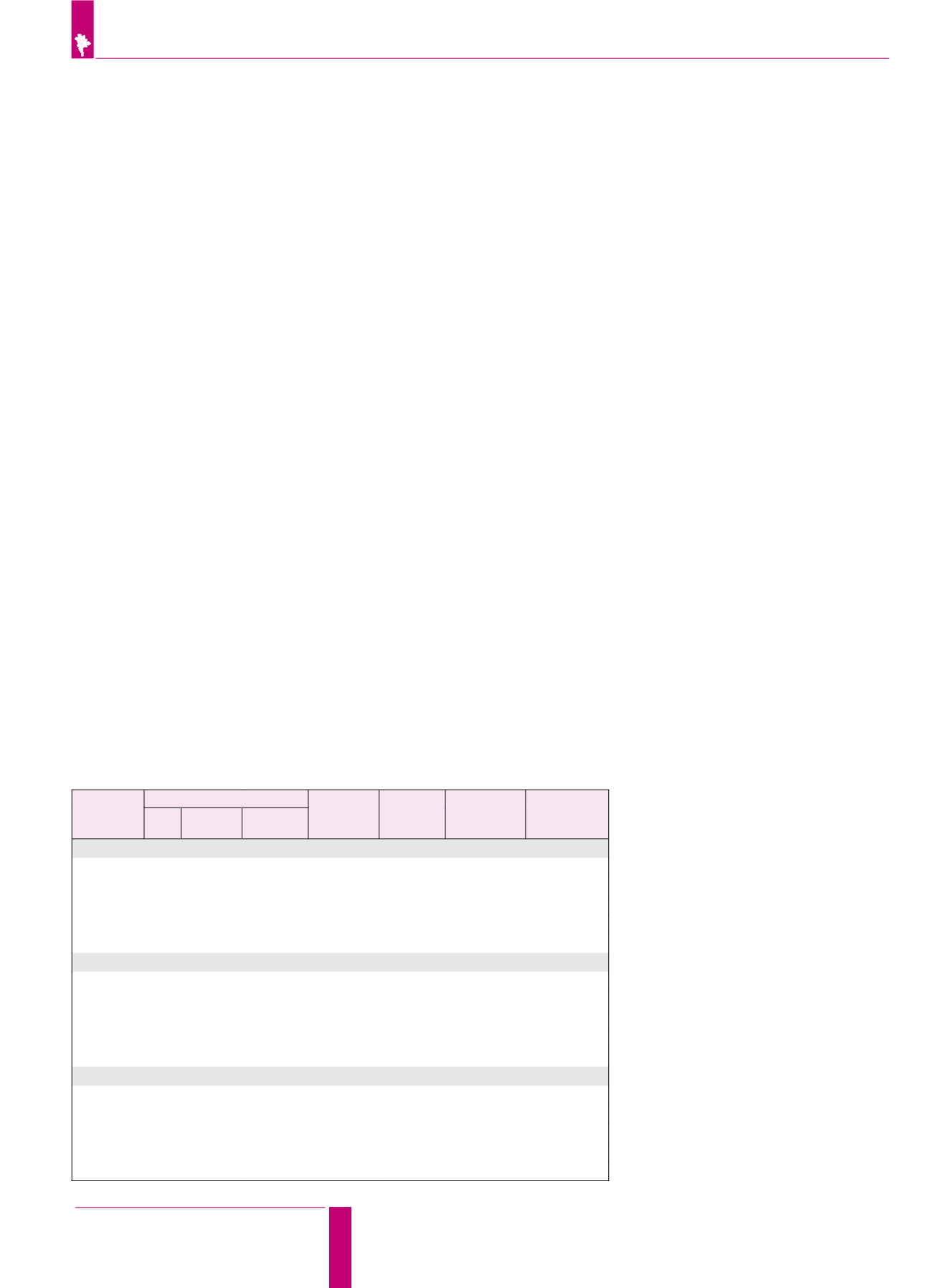
Цефотаксим,
мг/л
Корни
Высота
растения, см
Число
листьев
на побеге
Скорость
роста побегов,
см/сут
Коэффициент
полярности
число длина, см ризогенная
зона, см
Через 40 сут культивирования
Контроль
3,0
2,7
8,1
2,0
2,7
0,05
4,1
250
3,0
2,2
6,6
2,6
4,0
0,07
2,5
350
3,9
1,7
6,6
2,7
2,1
0,07
2,4
450
4,4
2,1
9,2
3,0
3,9
0,08
3,1
550
2,7
1,6
4,3
1,6
2,3
0,04
2,7
Через 70 сут культивирования
Контроль
3,2
4,1
13,1
4,7
6,1
0,07
2,8
250
3,7
2,3
8,5
5,8
7,7
0,08
1,5
350
5,3
2,5
13,3
6,5
7,3
0,09
2,0
450
4,8
2,6
12,5
7,2
8,3
0,1
1,7
550
4,3
2,1
9,0
5,1
5,9
0,07
1,8
Через 90 сут культивирования
Контроль
3,5
4,1
14,4
6,8
8,5
0,08
2,1
250
4,5
2,4
10,8
8,2
10,5
0,09
1,3
350
5,6
2,7
15,1
9,5
10,7
0,11
1,6
450
5,7
2,5
14,3
10,6
11,0
0,12
1,3
550
4,7
2,2
10,3
7,8
8,9
0,09
1,3
Таблица 6
Электронная Научная СельскоХозяйственная Библ отека









