
ТЕХНОЛОГИИ ЗАГОТОВКИ, ХРАНЕНИЯ И ИСПОЛЬЗОВАНИЯ КОРМОВ
ͪКормопроизводствоͫ № 3, 2016
www.kormoproizvodstvo.ru42
Методика исследований.
Количество микотоксинов:
афлатоксина М1 (АФЛАМ1), афлатоксинов (АФЛА), охраток-
сина А (ОТА), Т-2 токсина (Т-2), зеараленона (ЗЕН), дезоксини-
валенола (ДОН), — в образцах травостоя, силоса и молока
определяли иммуноферментным методом (ИФА), используя
тест-системы
AgraQuant
TM
(
Romer Labs, Inc
., Австрия) согласно
рекомендациям производителя. Микотоксины, за исключе-
нием ДОН, экстрагировали из проб 70% метанолом, ДОН —
дистиллированной водой. Оптическую плотность (
OD
) из-
меряли при λ = 450 нм с использованием микрострипового
фотометра
Stat Fax
303+ (
Awareness
Technology, Inc.
, США), со-
поставляя показатели для образца и для стандартов.
Научно-хозяйственный опыт по скармливанию кормовой
добавки «Заслон» проводили в ЗАО ПЗ «Большевик» на 20 ко-
ровах 2 и 3-й текущей лактации. Группы-аналоги отбирались
по продуктивности, живой массе, срокам отёла, количеству
лактаций. Препарат «Заслон» вводили в рацион, смешивая
его с комбикормом из расчёта 20 г на 1 голову в сутки. Про-
должительность эксперимента составляла 124 дня.
Содержание белка в молоке определяли колориметри-
ческим методом (ГОСТ 23327-98), жира — кислотным мето-
дом (ГОСТ 5867-90).
Отбор проб крови проводили утром до начала кормле-
ния (натощак), анализ проводили по стандартным методи-
кам (Кондрахин, 1969). Так, содержание общего белка опре-
деляли биуретовым методом, глюкозы — ферментативным
глюкозоксидазным методом, кальция и фосфора — на ав-
томатическом биохимическом анализаторе
KOBAS INTEGRА
400, мочевины — кинетическим методом (
UV
-тестом).
Пробы содержимого рубца для изучения состава ми-
кробного сообщества отбирали зондом.
Состав микробного сообщества рубца коров исследо-
вали методом анализа
T-RFLP
. Тотальную ДНК из образцов
выделяли с помощью набора
Genomic DNA Purification Kit
(
Fermentas, Inc.
, Литва) согласно рекомендациям производи-
теля. ДНК-амплификацию проводили с использованием ДНК-
амплификатора
Verity
(
Life Technologies, Inc.
, США) с помощью
эубактериальных праймеров 63F (
CAGGCCTAACACATGCAAGTC
)
с меткой на 5’-конце (флуорофор
WellRed
D4
) и 1492
R
(
TACGGHTACCTTGTTACGACTT
).
Флуоресцентно меченые ампликоны гена 16
S рРНК
очи-
щали по стандартной методике. Рестрикцию ампликонов 16
S
рРНК
(30–50 нг) проводили рестриктазами
HaeIII
,
HhaI
и
MspI
,
следуя рекомендации изготовителя (
Fermentas
). Продукты
рестрикции анализировали с помощью
CEQ
8000 (
Beckman
Coulter
, США) согласно рекомендациям производителя. По-
грешность прибора
CEQ
8000 составляла не более 5%.
Принадлежность бактерий к определённой филогенети-
ческой группе определяли с помощью программы
Fragment
Sorter
(http://www.oardc.ohiostate.edu/trflpfragsort/index.php).
Математическую и статистическую обработки резуль-
татов проводили с использованием программного обе-
спечения
Microsoft Excel
2010. Использовались методы мно-
жественного корреляционного и дисперсионного анализа
(Лакин, 1990).
Результаты исследований
. В 2013–2015 годах специ-
алисты ООО «БИОТРОФ» провели обширный мониторинг со-
держания микотоксинов в кормовом травостое и силосе из
животноводческих хозяйств Российской Федерации. Было
исследовано 68 проб кормового травостоя из 11 животно-
водческих хозяйств Ленинградской области и 215 проб сило-
са — из 20 животноводческих хозяйств Ленинградской, Мо-
сковской, Ярославской, Кировской, Воронежской, Липецкой
областей, республик Мордовия, Саха-Якутия, Краснодарско-
го края и др. с использованием метода иммуноферментного
анализа (ИФА).
На рисунке 1 приведены средние данные по РФ о содер-
жании отдельных микотоксинов во всех исследованных про-
бах силоса в сравнении с уровнями ПДК (Ветеринарно-сани-
тарные требования Таможенного союза, 2010).
Выяснилось, что проблема загрязнения силоса микоток-
синами стоит намного острее, чем проблема контаминации
зерна и комбикормов. Практически во всём исследованном
отечественном силосе были превышены уровни предельно
допустимых количеств микотоксинов.
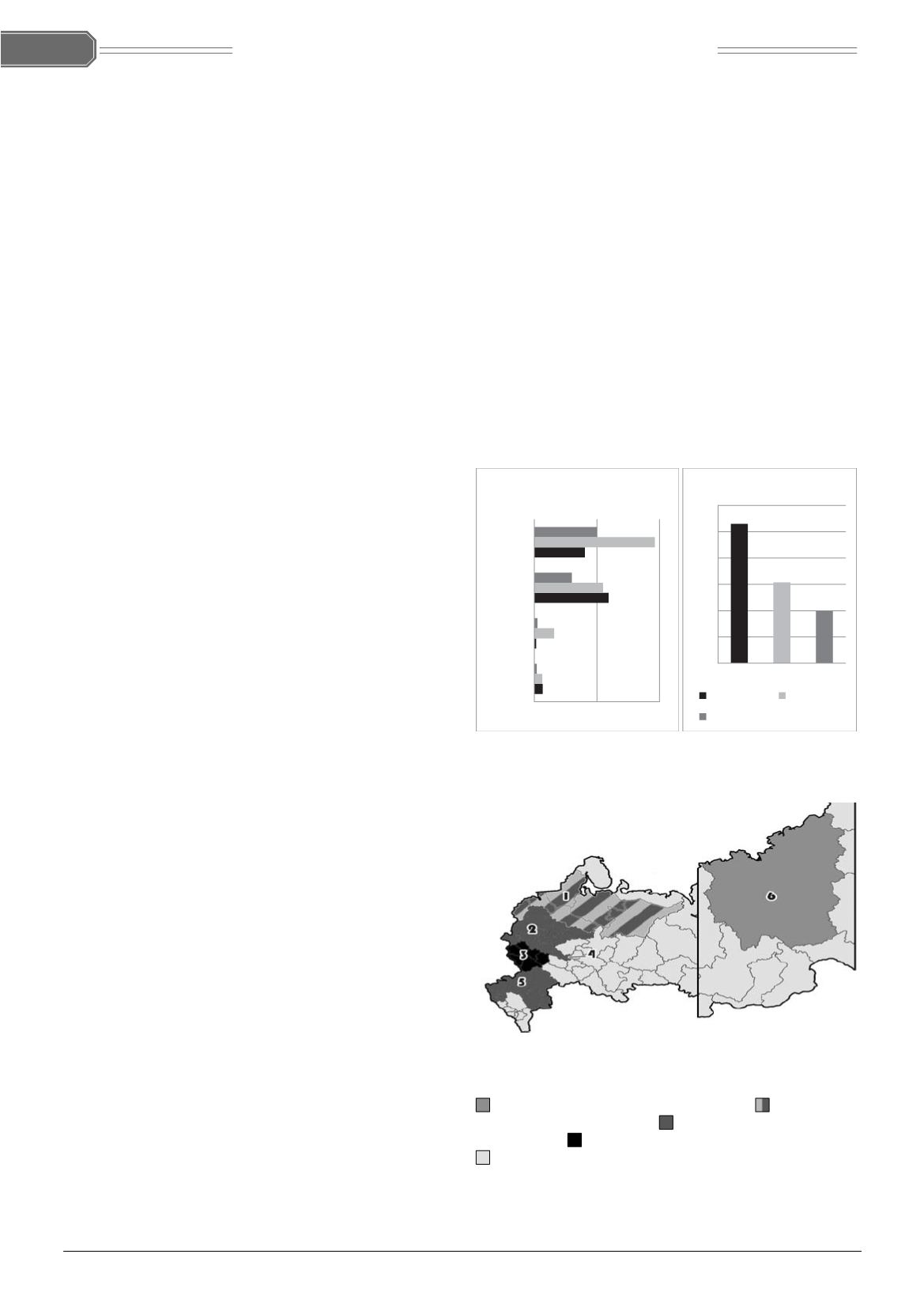
На рисунке 1 приведена карта распространения мико-
токсинов в силосе из животноводческих хозяйств различ-
ных регионов Российской Федерации, которая представ-
ляет собой обобщённые данные исследований компании
«БИОТРОФ». Как было отмечено выше, микотоксины в кор-
Рис. 1. Среднее содержание микотоксинов в силосе
из траншей и кормовом травостое (мг/кг)
0
0,1
0,2
АФЛА
ОТА
Т-2
ЗЕН
Содержание ЗЕН, Т-2,
ОТА и АФЛА
0
0,5
1
1,5
2
2,5
3
Травостой Силос
ПДК
Содержание ДОН
Травостой Силос
ПДК
Рис. 1. Карта распространения микотоксинов в силосе
из животноводческих хозяйств различных регионов
Российской Федерации:
— суммарная токсичность от 8 до 10 ПДК;
— суммарная
токсичность от 11 до 15 ПДК;
— суммарная токсичность от
16 до 20 ПДК;
— суммарная токсичность 21 и более ПДК;
— территория, не охваченная исследованиями;
1 — Северо-Западный ФО; 2 — Центральный ФО (кроме Цент-
рально-Чернозёмного региона); 3 — Центрально-Черно-
зёмный регион; 4 — Республика Мордовия; 5 — Южный ФО;
6 — Республика Якутия
Э
лектр нная Научная СельскоХозяйственная Библиотека









