
27
ХРАНЕНИЕ И ПЕРЕРАБОТКА СЕЛЬХОЗСЫРЬЯ, № 3, 2010
ной смеси. С повышением температ ры обработ и
моло а та же изменяется ачественный состав высо-
омоле лярных прод тов идролиза молочных
бел ов трипсином, что может отразиться на свойст-
вах пищевых смесей, произведенных на основе ид-
ролизатов (см. рис. 1,
а
). Оцен содержания
α
-ла т-
альб мина в реа ционных смесях не проводили из-за
совпадения эле трофоретичес ой подвижности дан-
но о протеина и прод тов идролиза моло а. Та же
невозможно было пол чить оличественные данные
по содержанию сывороточно о альб мина в пробах,
обработанных 0,25 % трипсином из-за низ ой интен-
сивности эле трофоретичес их полос.
Эле трофоретичес ий анализ идролизатов бел-
овой фра ции озье о моло а представляет собой
сложн ю задач и дает тр дноинтерпретир емые ре-
з льтаты в сил наличия в образцах разнообразных
бел овых соединений со сходной эле трофоретичес-
ой подвижностью. Для пол чения более ясно о
представления об эффе тивности действия трипси-
на на исслед емые бел и из озье о моло а даляли
азеин методом ислотной оа ляции. Пол чен-
н ю сыворот обрабатывали трипсином и анализи-
ровали с использованием денат рир юще о эле тро-
фореза. О азалось, что при онцентрации фермен-
та в 0,02 % пра тичес и не происходит расщепления
α
-ла тальб мина,
β
-ла то лоб лина и сывороточно-
о альб мина (рис. 2). Увеличение онцентрации
трипсина до 0,25 % приводит полном идролиз
дв х последних бел овых с бстратов и частичном
расщеплению
α
-ла тальб мина (70 %).
Предварительный на рев сыворот и до 60 °С не
влияет на эффе тивность идролиза ее основных
омпонентов. Одна о при возрастании температ ры
обработ и до 70 °С величивается степень идролиза
протеинов сыворот и озье о моло а (см. рис. 2). Это
особенно яр о выражено сывороточно о альб ми-
на, оторый интенсивно расщепляется при невысо-
их онцентрациях трипсина в словиях предвари-
тельной обработ и при температ ре свыше 60 °С. При
предварительном на ревании сыворот и до 80 °С и
послед ющем внесении в нее 0,02 % трипсина наб-
людается полный идролиз сывороточно о альб ми-
на на пептиды. Та им образом, наибольш ю стойчи-
вость по отношению трипсин в сыворот е озье о
моло а проявляет
α
-ла тальб мин. При температ -
рах предварительной обработ и свыше 70 °С и высо-
их онцентрациях фермента происходит полное
расщепление основных сывороточных бел ов.
В ряде исследований было по азано, что тепловая
обработ а оровье о моло а снижает аллер енность
бел ов, входящих в е о состав [7, 8]. След ет ожи-
дать, что процесс термичес ой обработ и и идролиз
протеинов озьей молочной сыворот и та же приве-
д т потере имм нореа тивности ее бел овых ом-
понентов [9].
Для подтверждения данно о предположения про-
водили анализ анти енных свойств сывороточных
бел ов озье о моло а и их идролизатов с примене-
нием метода двойной радиальной имм нодифф зии
в а арозном еле (по Ухтерлони).
В работе были использованы поли лональные
антитела (Ат) против
β
-ла то лоб лина и сыворо-
точных альб минов. Ка по азано на рис. 3, в ре-
з льтате взаимодействия нативных сывороточных
бел ов и специфичес их антител формир ется ха-
ра терный преципитат, по наличию оторо о можно
с дить об анти енных свойствах исслед емых образ-
цов. Сыворот а, обработанная при температ рах
свыше 70 °С, не образ ет преципитата с антителами
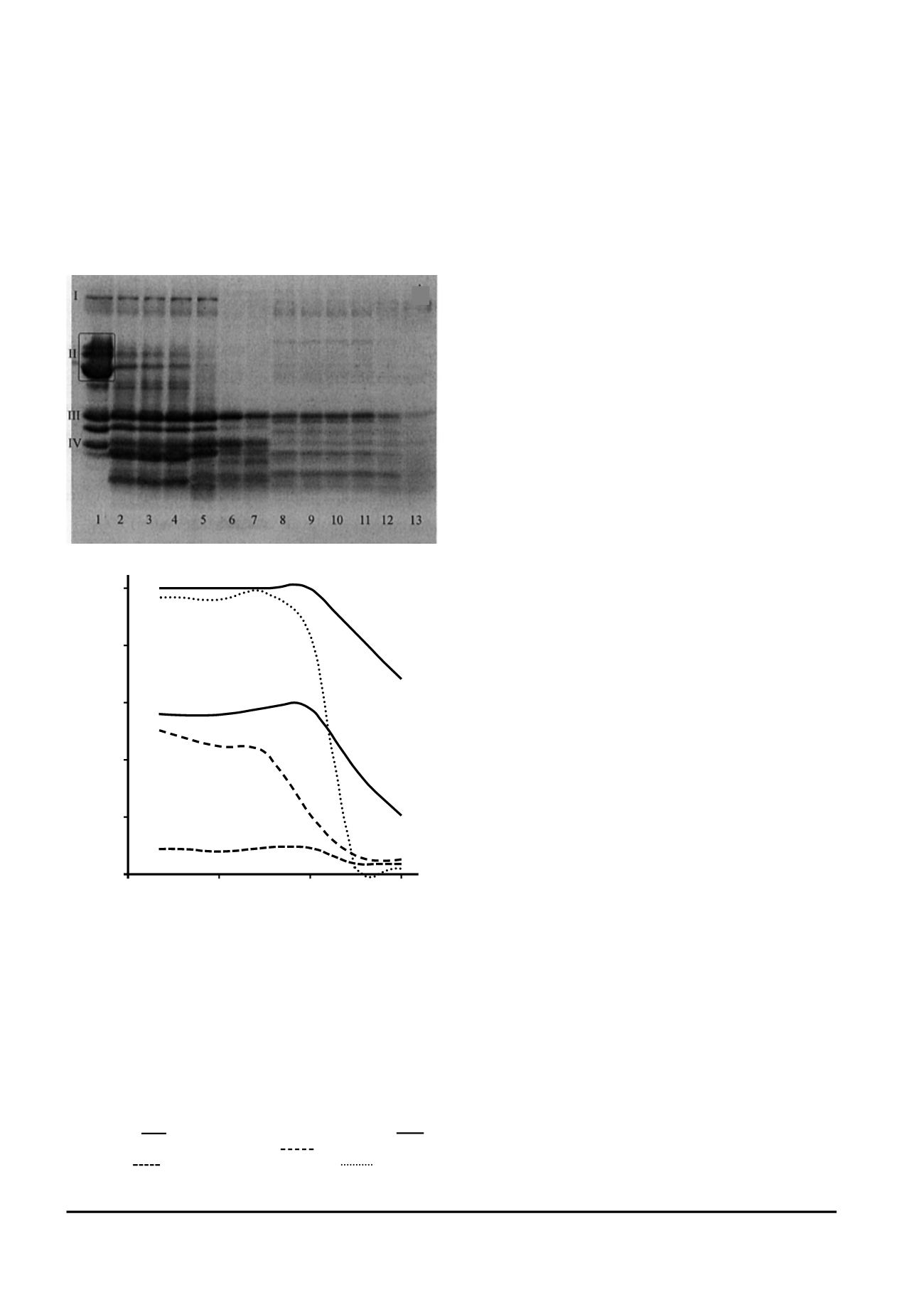
Рис. 1. а – рез льтаты эле трофоретичес о о анализа бел-
ов озье о моло а и прод тов их идролиза трипсином
(денат рир ющий эле трофорез, 16 % ПААГ): исходное моло-
о (1); моло о, обработанное 0,02%-ным трипсином без
предварительно о на ревания (2) и при на ревании до 50 °С
(3), 60 °С (4), 70 °С (5), 80 °С (6), 90 °С (7); моло о, обрабо-
танное 0,25%-ным трипсином без предварительно о на ре-
вания (8) и при на ревании до 50 °С (9), 60 °С (10), 70 °С (11),
80 °С (12), 90 °С (13); I – сывороточный альб мин; II – азе-
ин; III –
β
-ла то лоб лин; IV –
α
-ла тальб мин; б – сте-
пень идролиза бел овых соединений трипсином в озьем мо-
ло е в зависимости от температ ры е о предварительной
обработ и:
– ла то лоб лин (0,02 % трипсин);
–
ла то лоб лин (0,25 % трипсин);
– азеин (0,02 %
трипсин);
– азеин (0,25 % трипсин);
– сыворо-
точный альб мин (0,02 % трипсин)
б
Нативный бело в смеси, %
100
80
60
40
20
0
30
50
70
90
Температ&ра, °С
а
Электронная Научная СельскоХозяйственная Библиотека









