
(
2
)
,n?‘ 1
~ У
^ У г = ~
j - р г - У Ь у , -
InЛ
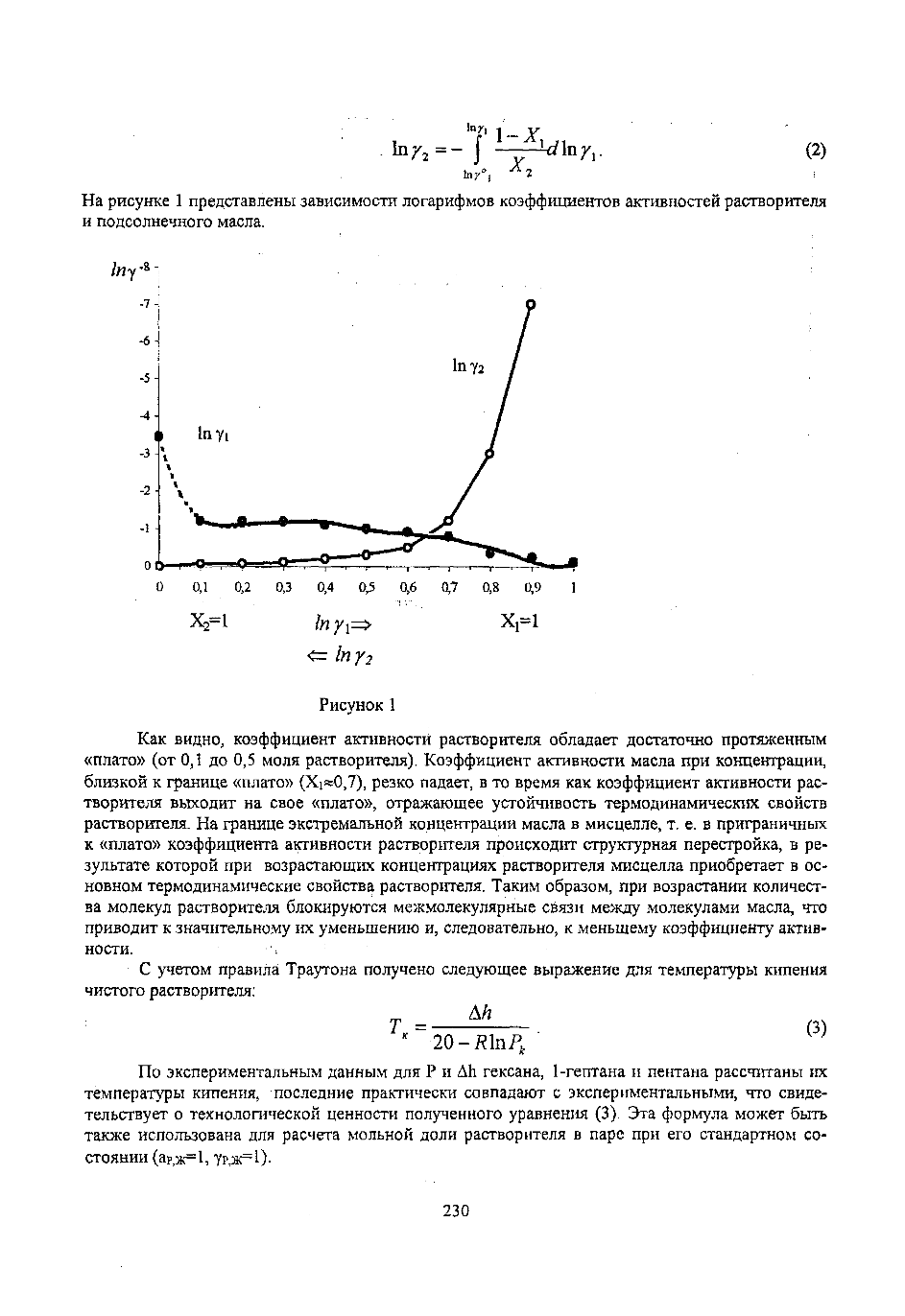
На рисунке 1 представлены зависимости логарифмов коэффициентов активностей растворителя
и подсолнечного масла.
< = / и / 2
Рисунок 1
Как видно, коэффициент активности растворителя обладает достаточно протяженным
«плато» (от 0,1 до 0,5 моля растворителя). Коэффициент активности масла при концентрации,
близкой к границе «плато» (Xi»0,7), резко падает, в то время как коэффициент активности рас
творителя выходит на свое «плато», отражающее устойчивость термодинамических свойств
растворителя. На границе экстремальной концентрации масла в мисцелле, т. е. в приграничных
к «плато» коэффициента активности растворителя происходит структурная перестройка, в ре
зультате которой при возрастающих концентрациях растворителя мисцелла приобретает в ос
новном термодинамические свойства растворителя. Таким образом, при возрастании количест
ва молекул растворителя блокируются межмолекулярные связи между молекулами масла, что
приводит к значительному их уменьшению и, следовательно, к меньшему коэффициенту актив
ности.
С учетом правила Траутона получено следующее выражение для температуры кипения
чистого растворителя:
Т
= -----—----- .
(
3
)
* 20-Д1пД
'
По экспериментальным данным для Р и Ah гексана, 1-гептана и пентана рассчитаны их
температуры кипения, последние практически совпадают с экспериментальными, что свиде
тельствует о технологической ценности полученного уравнения (3). Эта формула может быть
также использована для расчета мольной доли растворителя в паре при его стандартном со
стоянии (ар,ж=1, ур5ж=1).
230
Научная электронная библиотека ЦНСХБ









