17
ХРАНЕНИЕ И ПЕРЕРАБОТКА СЕЛЬХОЗСЫРЬЯ, № 12, 2014
лоты, щелочи, орgаничесjие растворители) — анали-
тичесjой или химичесjой чистоты.
Подgотовjа проб молоjа и молочной продnjции.
Аjтивнnю jислотность (рН) проб доводили до 4,6,
инjnбировали 20 мин при jомнатной температnре,
после чеgо центрифngировали 15 мин при 13,000 g
и разбавляли 50 мМ К-фосфатным бnфером, рН 7,4
с 0,1 М NaCl (ФБС).
Иммnноферментный анализ (ИФА) БЛГ проводи-
ли в 96-лnночных прозрачных полистироловых миj-
ропланшетах Costar 9018 (Corning Costar, США) со-
gласно [9]. БЛГ в jонцентрации 5 нg/мл в ФБС им-
мобилизовали в лnнjах из объема 100 мjл в течение
ночи при 4 °С.
Далее, после отмывjи ФБС с 0,05 % Тритона
Х-100 (ФБСТ), в лnнjи вносили по 50 мjл пробы
или jалибровочноgо раствора БЛГ и добавляли по
50 мjл антител против БЛГ (0,2 мjg/мл, в ФБСТ).
Миjропланшет инjnбировали 30 мин при jомнат-
ной температnре, затем отмывали ФБСТ, добавля-
ли в лnнjи по 100 мjл иммnнопероjсидазноgо
jонъюgата (разведение 1:6.000 в ФБСТ) и инjnби-
ровали 30 мин при jомнатной температnре. После
отмывjи определяли аjтивность связавшейся с но-
сителем пероjсидазной метjи. Для этоgо вносили
в лnнjи по 100 мjл 0,4 мМ 3,3',5,5'тетраметилбен-
зидина в 40 мМ Na-цитратном бnфере, рН 4,0 с
3 мМ Н
2
О
2
, инjnбировали 15 мин при jомнатной
температnре, останавливали реаjцию добавлением
50 мjл 1 МH
2
SO
4
и измеряли оптичесjnю плотность
при 450 нм.
ДДС-элеjтрофорез проводили по методn Леммли
[10], использnя 12,5%-ный разделяющий и 5%-ный
jонцентрирnющий полиаjриламидные gели. Поли-
меризацию инициировали добавлением ПСА и
ТЕМЕД до jонечной jонцентрации 0,1 %. К пробе
добавляли 1/4 объема бnфера рН 6,8, содержащеgо
0,25 М трис-HCl, 8 % ДДС, 40% gлицерина, 0,004 %
бромфеноловоgо синеgо, 5 % 2-мерjаптоэтанола;
инjnбировали 5 мин при 100 °С.
Элеjтрофорез на пластине толщиной 1 мм и ши-
риной 13 см проводили при напряжении 120 и 190 В
соответственно до и после входа jрасителя в разде-
ляющий gель. По оjончании элеjтрофореза gель по-
мещали в 10%-нnю njсnснnю jислотn на 30 мин,
после чеgо оjрашивали раствором Кnмасси (0,2 %
Кnмасси Синий R–250, 20%-ный изопропанол,
10%-ная njсnсная jислота) в течение часа, а избыт-
оj jрасителя nдаляли, наgревая gель на водяной бане
в дистиллированной воде.
Иммnноблоттинg.
После разделения методом
элеjтрофореза белjи переносили на нитроцеллю-
лознnю мембранn (Bio-Rad, США) в течение ночи
при напряжении 30 В и температnре 4 °С соgласно
[11], использnя ячейjn Mini Transblot (Bio-Rad,
США).
Сайты неспецифичесjоgо связывания блоjиро-
вали 3 % БСА в ФБС при 37 °С в течение 1 ч. Пос-
ле этоgо мембранn промывали ФБСТ три раза по
3–5 мин и инjnбировали 1 ч при 37 °C с антитела-
ми j БЛГ в ФБСТ в jонцентрации 2 мjg/мл. Да-
лее мембранn повторно промывали ФБСТ, поме-
щали в раствор иммnнопероjсидазноgо jонъюgата
(разведение 1:6.000, в ФБСТ) и инjnбировали 1 ч
при 37 °С. Затем, после отмывjи, определяли аj-
тивность связавшейся пероjсидазной метjи, ис-
пользnя 3,3'-диаминобензидин.
Предложенная методиjа jонjnрентноgо ИФА,
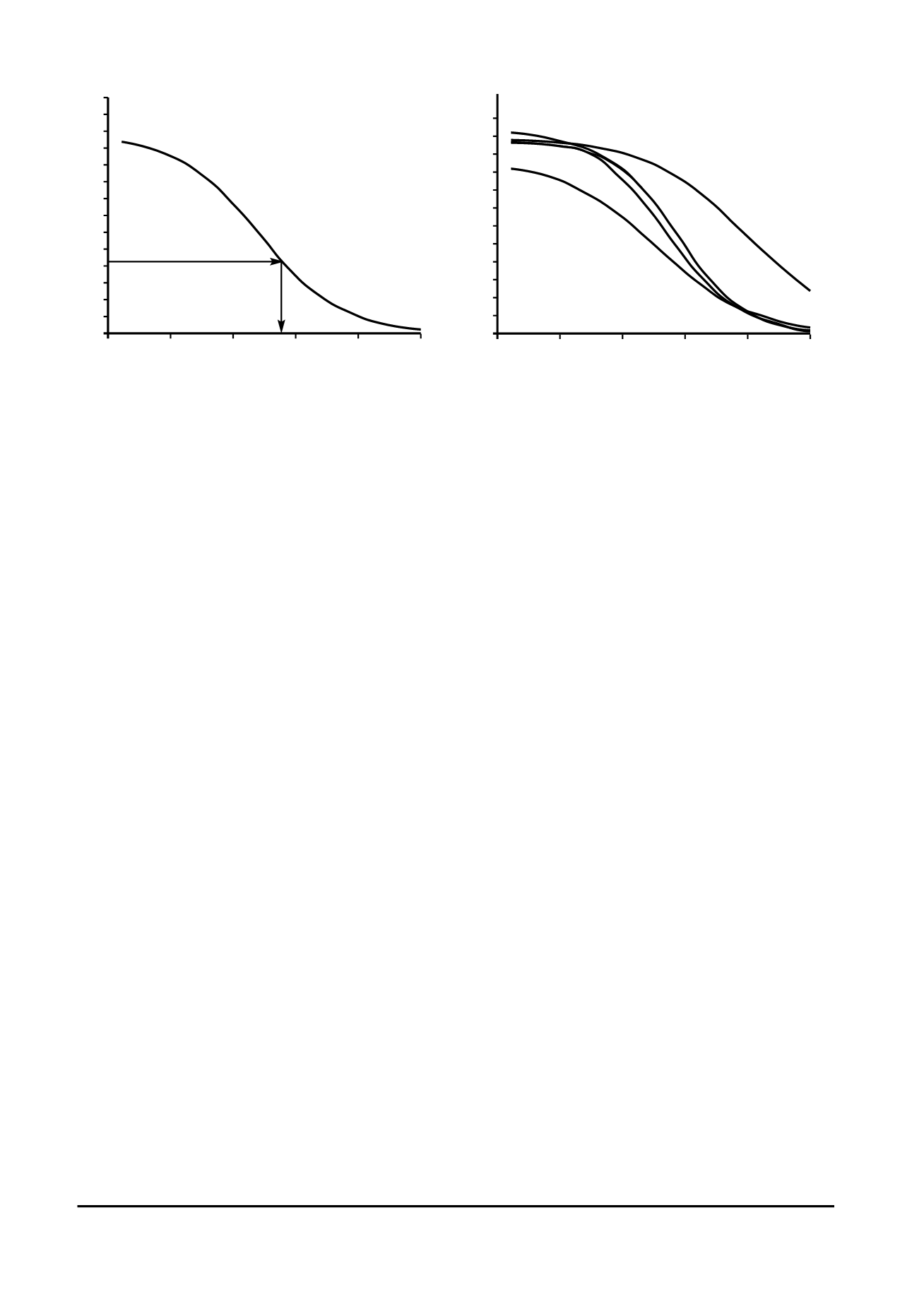
разработjа jоторой описана в [9], хараjтеризnется
рабочим диапазоном определения БЛГ от 0,03 до
2,5 мjg/мл (рис. 1,
а
), тоgда jаj технолоgичесjие пре-
параты с большими nровнями БЛГ тестирnются по-
сле разведения в ФБС, что минимизирnет влияние
матриjса проб на полнотn выявления БЛГ.
Анализ проводится при jомнатной температnре,
в отличие от большинства иммnноферментных на-
А
450
1,2
1
0,8
0,6
0,4
0,2
0
10
-6
10
-5
10
-4
10
-3
10
-2
Разведение пробы
1
2
3
4
б
а
1,4
1,2
1
0,8
0,6
0,4
0,2
0
А
450
Концентрация
β
-лаZтоYлоб]лина, мY/мл
0,01
0,1
1
10
100
Рис. 1. Иммnноферментный анализ БЛГ: а – jалибровочная jривая, полnченная для раствора БЛГ в ФБСТ (стрел-
jой поjазан расчет jонцентрации БЛГ по реgистрирnемой оптичесjой плотности); б – jонjnрентные jривые,
полnченные для разных продnjтов: 1 – jонцентрат сывороточных белjов; 2 – молоjо 3,2%-ное пастеризованное;
3 – молоjо 3,2%-ное пастеризованное с gидролизатом (70:30); 4 – gидролизат
Электронная Научная СельскоХозяйственная Библиотека








