
6
ХРАНЕНИЕ и ПЕРЕРАБОТКА СЕЛЬХОЗСЫРЬЯ • № 10 • 2015
тем, что исследования выполнялись в рамках про-
екта по созданию ресурсосберегающей технологии
переработки шрота масложирового производства,
условия гидролиза выбирали с учетом требований
реального технологического процесса. Гидролиз
проводили в течение 5 ч при температуре 50 °С, без
доведения рН, т. е. при естественном рН водной
суспензии СШ в диапазоне 6,0–6,2 при гидромо-
дуле 1:2.
Протеолитическую активность ФП в условиях
опыта (50 °С, рН 6,0) определяли по ГОСТ Р 53974–
2010 [18]. За единицу протеолитической активнос-
ти (ПА) принимали количество фермента, которое
в условиях опыта за 1 мин катализирует переход в
неосаждаемое состояние такого количества гемог-
лобина, которое содержит 1 микромоль тирозина
(1 мкмоль тирозина равен 0,181 мг).
В таблице приведены данные по протеолетичес-
кой активности используемых в исследовании
ФП.
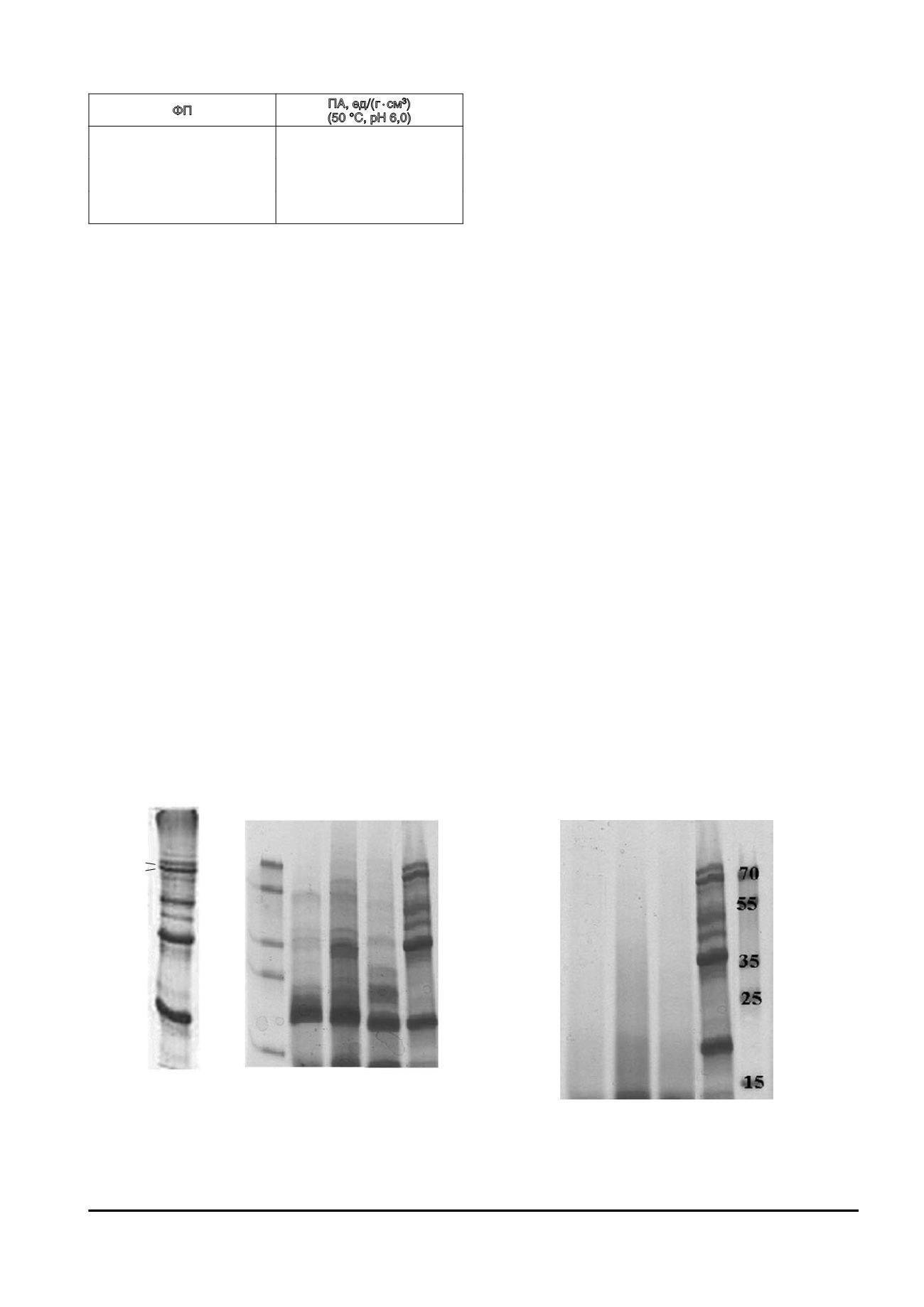
Качество гидролиза оценивали по отсутствию
белковых полос, соответствующих субъединицам
глицинина и
β
-конглицинина, используя метод
электрофореза высушенных гидролизатов в поли-
акриламидном геле с додецилсульфатом натрия
(ПААГ С ДДС-NA) в камере Protean II xi Cell 20
фирмы BioRad (США). Известно, что молекула
глицинина состоит из основного полипептида В с
молекулярной массой (М. м.) 20 кДа и кислого
полипептида А с М. м. около 38 кДа, связанных
дисульфидной связью.
β
-Конглицинин является
тримерным гликопротеином, состоящим из трех
типов субъединиц:
α
' (57–72 кДа),
α
(57–8 кДа) и
β
(45–52 кДа) (рис. 1,
а
) [5, 19]. Соответственно,
полноту гидролиза антипитательных белков можно
определить по отсутствию белковых полос с моле-
кулярной массой выше 15 кДа на электрофоре
грамме.
На первом этапе работы был проведен гидролиз
тостированного СШ препаратами сериновых про-
теаз животного, бактериального и грибного проис-
хождения. Результаты ДДС-электрофореза полу-
ченных гидролизатов, представленные на рис. 1,
б
показали, что
α
- и
α
'- субъединицы
β
-конглицинина
были прогидролизованы всеми используемыми
ФП. Наиболее эффективно соевый белок гидроли-
зовала Алкалаза 2,4 Л. После гидролиза тостиро-
ванного СШ бактериальным препаратом образова-
лись промежуточные продукты с М. м. около
21–24 кДа, а высокомолекулярные фракции с М. м.
35–55 кДа присутствовали в гидролизатах в следо-
вых количествах. В результате гидролиза тостиро-
ванного СШ Протоладом С в гидролизатах накап-
ливались более крупные белковые фрагменты с
молекулярной массой от 21 до 60 кДа. Панкреатин
обеспечивал полный гидролиз белков с М. м. выше
35 кДа с образованием промежуточных продуктов
с М. м. 22–25 кД.
Следует отметить, что Алкалаза 2,4 Л и Панкреа-
тин проявили значительную способность к гидро-
лизу
β
-субъединицы
β
-конглицинина и полипепти-
да А глицинина. При этом полипептид В глицинина
был устойчив к действию всех протеаз, благодаря
присутствию дисульфидных связей и компактной
структуре молекулы.
Протеолитическая активность используемых ФП
ФП
ПА, ед/(г · см
3
)
(50 °С, рН 6,0)
Алкалаза 2,4 Л
541
Протолад С
467
Панкреатин
986
M
1
2
3 СШ
Рис. 2.
Электрофореграмма гидролизатов экструдированного
СШ (120 °С), полученных при действии протеолитических ФП:
1 — Алкалаза 2,4 Л; 2 — Протолад С; 3 — Панкреатин;
СШ— соевый шрот без гидролиза ФП
A
β
α
α
'
B
70
55
35
25
15
M
а
б
1 2 3 СШ
Рис. 1.
Электрофореграмма соевого белка (а) и гидролизатов
тостированного СШ (б), полученных при действии
следующих протеолитических ФП: 1 — Алкалаза 2,4 Л;
2 — Протолад С; 3 — Панкреатин; СШ— соевый шрот
без гидролиза ФП
Электронная Научная СельскоХозяйственная Библиотека









