
2
•
2014
ПИВО
и
НАПИТКИ
33
КОНТРОЛЬ КАЧЕСТВА
КОНТРОЛЬ КАЧЕСТВА
20,0 г/100см
3
), гидроортофосфат ам-
мония (1,53 г/л), сернокислый аммо-
ний (4,6 г/л) и водопроводная вода.
Морфологические исследования
проводили на световом микроскопе
СХ-21 (OLYMPUS, Япония). Ис-
следование содержания свободных
органических кислот в питательных
средах и сброженных субстратах осу-
ществлялось методом капиллярного
электрофореза на приборе «Капель-
105» (Россия) [11, 12].
В отличие от дрожжей
S. сerevisiae
,
применяемых в процессе получения
этанола из мелассы, элективной пи-
тательной средой для используемого
в винодельческой промышленности
штамма
S. оviformis M-12Х
служит
виноградное сусло при оптимальных
значениях рН 2,9–3,6 и температуры
20 °С. Адаптационный процесс данной
культуры способствовал выявлению
и отбору наиболее приспособленных
форм дрожжей
M-12Х
к неблагоприят-
ным примесяммелассной питательной
среды, рН 4,5, температуре 30…32 °С.
Отмечена отличительная способность
адаптированных клеток
S. оviformis
,
как и традиционных спиртовых дрож-
жей
S. сerevisiae
, наиболее полно
сбраживать углеводы мелассной
среды культивирования. В опытных
сброженных субстратах, независимо
от вида используемых дрожжей, обна-
ружено повышенное образование эта-
нола:
S. сerevisiae
— 11,4:9,7 об. %
и
S. оviformis
—10,4:9,4 об. %.
Аналогично, морфологические
исследования, проводимые на всех
этапах культивирования дрожжей,
показали изменение формы клеток,
более энергичное почкование и нако-
пление резервных веществ в опытных
вариантах исследуемых штаммов.
Так, в инокуляте
S. cerevisiae
в 1
мл содержалось 79,4 · 10
6
: 67,2 · 10
6
клеток (опыт : контроль); размер
8–9
×
12–13:6–7
×
11–12 мкм (опыт:
контроль); количество почкующих-
ся 31:27% (опыт:контроль). В 1 мл
инокулята
S. оviformis
содержалось
77,2·10
6
:65,3·10
6
клеток (опыт:кон-
троль); размер 7–8
×
12–13:6–7
×
10–
11 мкм (опыт:контроль); количество
почкующихся 32 : 27% (опыт : кон-
троль). Количество нежизнеспособных
клеток — 0,4–0,5% в опыте и 0,8–
0,9% в контроле — в исследуемых
штаммах идентично. По-видимому,
благоприятные условия для развития
дрожжевых организмов создает на-
личие в геотермальной воде микро-
и макроэлементов, борной, кремние-
вой кислот, органических веществ,
в частности, гуминовых кислот, ко-
торые способны действовать как мем-
бранотропные соединения [13]. Мор-
фология гигантских колоний — один
из параметров, по которому можно
оценивать действие таких соединений.
Нами исследованы двадцатисуточные
культуры, выращенные на плотной пи-
тательной среде (контрольной и опыт-
ной) в чашках Петри при 30 °С. Коло-
нии опытного варианта
Y-503
имели
форму цветка светло-палевого цвета,
М-12Х
— округлую палевого цвета.
В отличие от колоний, выращенных
на среде с геотермальной водой, кон-
трольные варианты характеризова-
лись меньшими размерами, измене-
нием формы, поверхности и профи-
ля. Обнаруженные отличия типичны
для исследуемых дрожжей и опреде-
ляются в конечном итоге набором
ферментов, обеспечивающих обмен
и жизнеспособность клеток данного
штамма.
Определенный интерес представ-
ляет исследование динамики содер-
жания некоторых свободных органи-
ческих кислот в мелассных питатель-
ных средах и сброженных субстратах.
В результате изучения состава низко-
молекулярных органических кислот
в средах культивирования дрожжей
S. оviformis
и
S. сerevisiae
нами
идентифицированы муравьиная, ук-
сусная, молочная, щавелевая, янтар-
ная, яблочная и лимонная кислоты
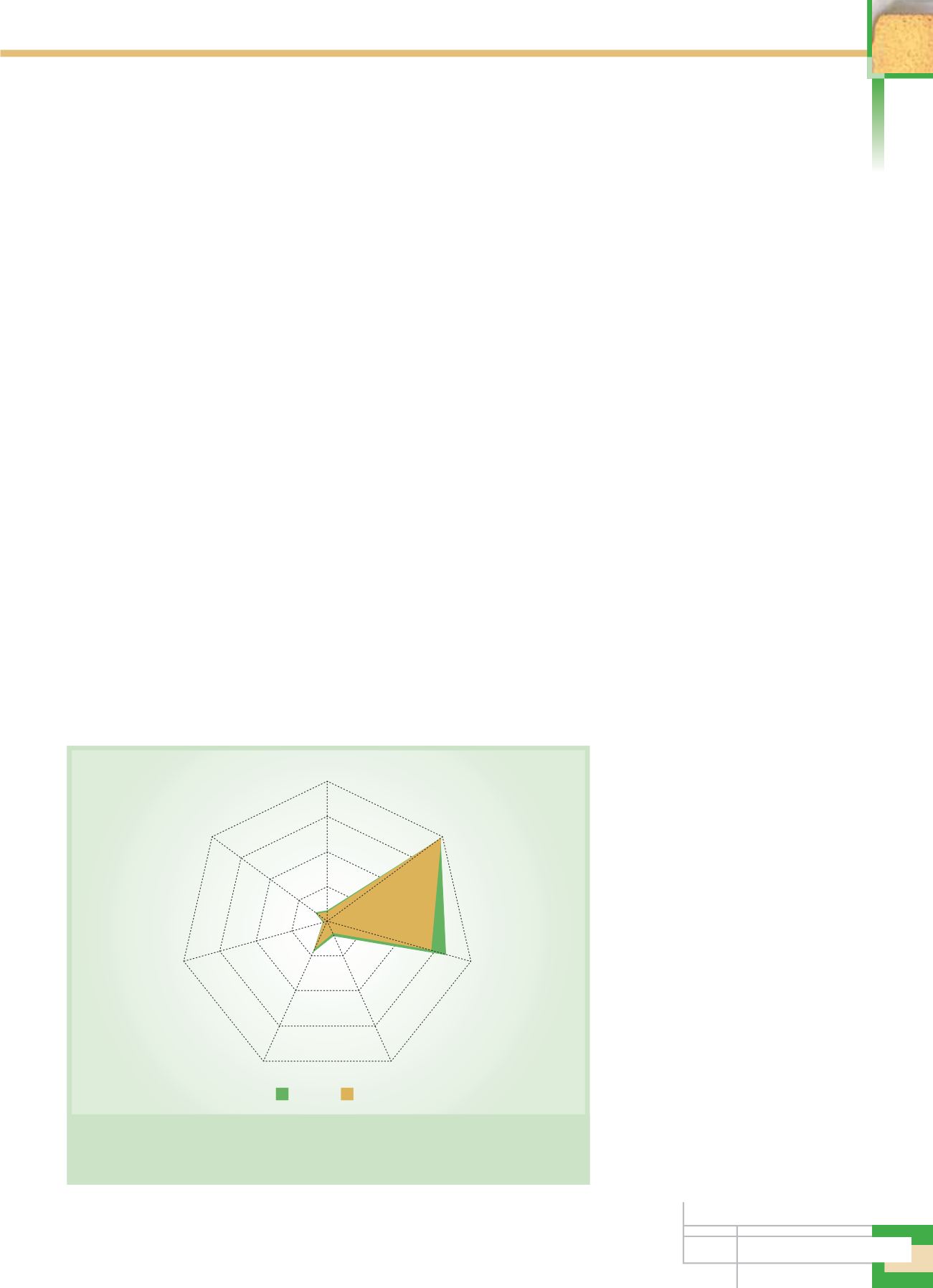
(рис. 1).
Как известно, в мелассе содержат-
ся нелетучие и летучие органические
кислоты; нелетучие попадают в ме-
лассу из свеклы и образуются из мо-
носахаров, в состав летучих входят
муравьиная, уксусная, пропионовая,
масляная, изомасляная, валериановая
и капроновая кислоты. Органические
кислоты в мелассе находятся в свобод-
ном состоянии и в виде солей. Многие
штаммы дрожжей
S. cerevisiae
, в том
числе и спиртовые, эффективно ис-
пользуют аммиачные соли уксусной,
молочной, яблочной и янтарной кис-
лот. Однако в присутствии достаточно-
го количества сбраживаемых сахаров,
как в нашем эксперименте, аммиачные
соли органических кислот служат
для дрожжей лишь источником азота
и как питательный материал не имеют
значения. Известно, что освобождаю-
щиеся при расщеплении солей свобод-
ные органические кислоты оказыва-
ют большее ингибирующее действие
на дрожжи, чем их соли. Присутствуя
в сбраживаемой среде, они задержи-
вают размножение дрожжевых клеток
и тормозят скорость биохимических
процессов. При сбраживании кон-
центрированных мелассных раство-
ров органические кислоты подавляют
действие ферментов, участвующих
в гликолитическом процессе. Мура-
вьиная кислота действует на многие
ферменты, обеспечивающие превра-
щение глюкозы в пировиноградную
8
6
4
2
0
Муравьиная
Уксусная
Молочная
Щавелевая
Янтарная
Контроль Опыт
Яблочная
Лимонная
Рис. 1.
Содержание органических кислот (г/л) в мелассных
питательных средах с использованием геотермальной воды
фенольного класса (опыт) и традиционной (контроль)
Электронная Научная СельскоХозяйственная Библиотека









