0,015—0,0125
0,001—0,0305 0,0012—0,0005 0,0012-0,0005
0,000125
#
Из таблички видно, что Н-ион по своей коагулирующей способности
близок к двувалентным катионам. Это же вытекает из следующего опыта
Гедройца (36). Почва насыщалась различными катионами — Na, Н, Mg,
-f- «—NaOH
Ркс. 30. Полное внедрение NaOH.
Са —и взбалтывалась с водой в цилиндрах. Через 7 месяцев определен*
была концентрация отстоя (в граммах на 100 см
3
раствора).
Na-почва
1,852
Н-почва
0,016
Mg-почва
0,000
Са-почва
0,000
Таким образом положение Н по его коагулирующей способности:
N a < H < X a ; при этом Н ближе к Са, чем к Na,
В случае наличия активных анионов ( Р0
4
, ОН) порог коагуляции
электролита повышается: анион мешает свертыванию, и нужно брать
более высокие концентрации электролита для того, чтобы добиться свер-
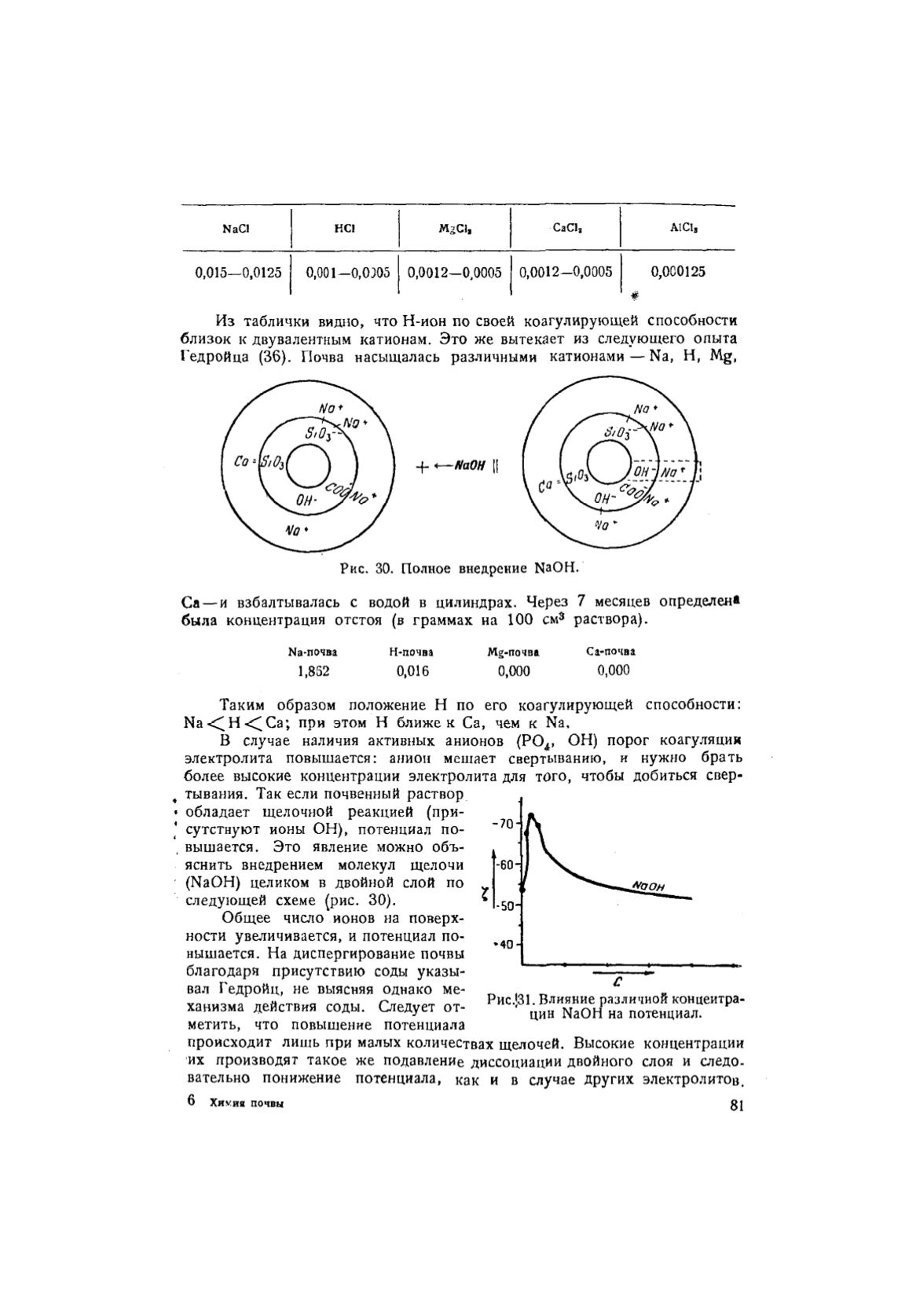
тывания. Так если почвенный раствор
обладает щелочной реакцией (при-
сутствуют ионы ОН), потенциал по-
вышается. Это явление можно объ-
яснить внедрением молекул щелочи
(NaOH) целиком в двойной слой по
следующей схеме (рис. 30).
Общее число ионов на поверх-
ности увеличивается, и потенциал по-
вышается. На диспергирование почвы
благодаря присутствию соды указы-
вал Гедройц, не выясняя однако ме-
ханизма действия соды. Следует от-
метить, что повышение потенциала
происходит лишь при малых количествах щелочей. Высокие концентрации
их производят такое же подавление диссоциации двойного слоя и следо-
вательно понижение потенциала, как и в случае других электролитов.
6
Химия
ПОЧВЫ
81
-70-
- 6 0 -
-50-
40 А
Рис.]31. Влияние различной концентра-
ции NaOH на потенциал.
Электронная книга СКБ ГНУ Россельхзакадемии


