
27
ПИЩЕВАЯ ПРОМЫШЛЕННОСТЬ
10/2011
TECHNICAL SUPPLY OF INDUSTRY
воды), боратный буфер (57,21 г
Nа
2
В
4
O
7
·10Н
2
O и 100 мл 1М НСl в 2 л
воды), суспензия ортофосфата меди
(II), индикатор – тимолфталеин.
Ход определения.
В мерную колбу
вместимостью 25 мл пипеткой вно%
сили аликвоту раствора аминокис%
лоты, добавляли 2–3 капли раствора
тимолфталеина и по каплям раствор
NаОН до появления голубой окрас%
ки. К полученному раствору прили%
вали суспензию ортофосфата меди,
содержимое колбы доводили до
метки водой, перемешивали и
фильтровали. Затем анализируемым
раствором заполняли стеклянные
кюветы фотоколориметра оптичес%
кой толщиной 30 мм.
Определение цветности проводи%
ли в специально сконструирован%
ном боксе, позволявшем стандарти%
зировать условия освещения. Зад%
няя стенка бокса представляла со%
бой белый экран. В качестве источ%
ника света использовали две гало%
генных лампы общей мощностью 70
Вт, дающих свет, близкий по спект%
ру к естественному освещению.
Изображение образца с помощью
оборачивающего зеркала направля%
ли вверх в объектив цифровой фо%
токамеры, находящейся в верхней
крышке бокса.
В работе использовали растворы
аминокислот и глицилглицина кон%
центрацией от 0,4 до 2,0 г/л. Для ре%
гистрации цифрового изображения
выбрали цифровую фотокамеру
(ЦФК) Olympus SP%500UZ (Япония),
имеющую возможности ручного из%
менения параметров съемки.
Для анализа цветности растворов
был создан пакет программ в среде
MathCAD 11, позволяющий автома%
тически рассчитывать средние зна%
чения кодов цветности в выбранной
области. В нем предусмотрен режим
градуировки, позволяющий по дан%
ным цифровых изображений стро%
ить градуировочные зависимости
яркостей каналов R, G и B от концен%
трации окрашенных компонентов, а
также выбрать диапазон градуиров%
ки. На основе данных градуировки
программа рассчитывает концентра%
ции анализируемого вещества и
метрологические характеристики
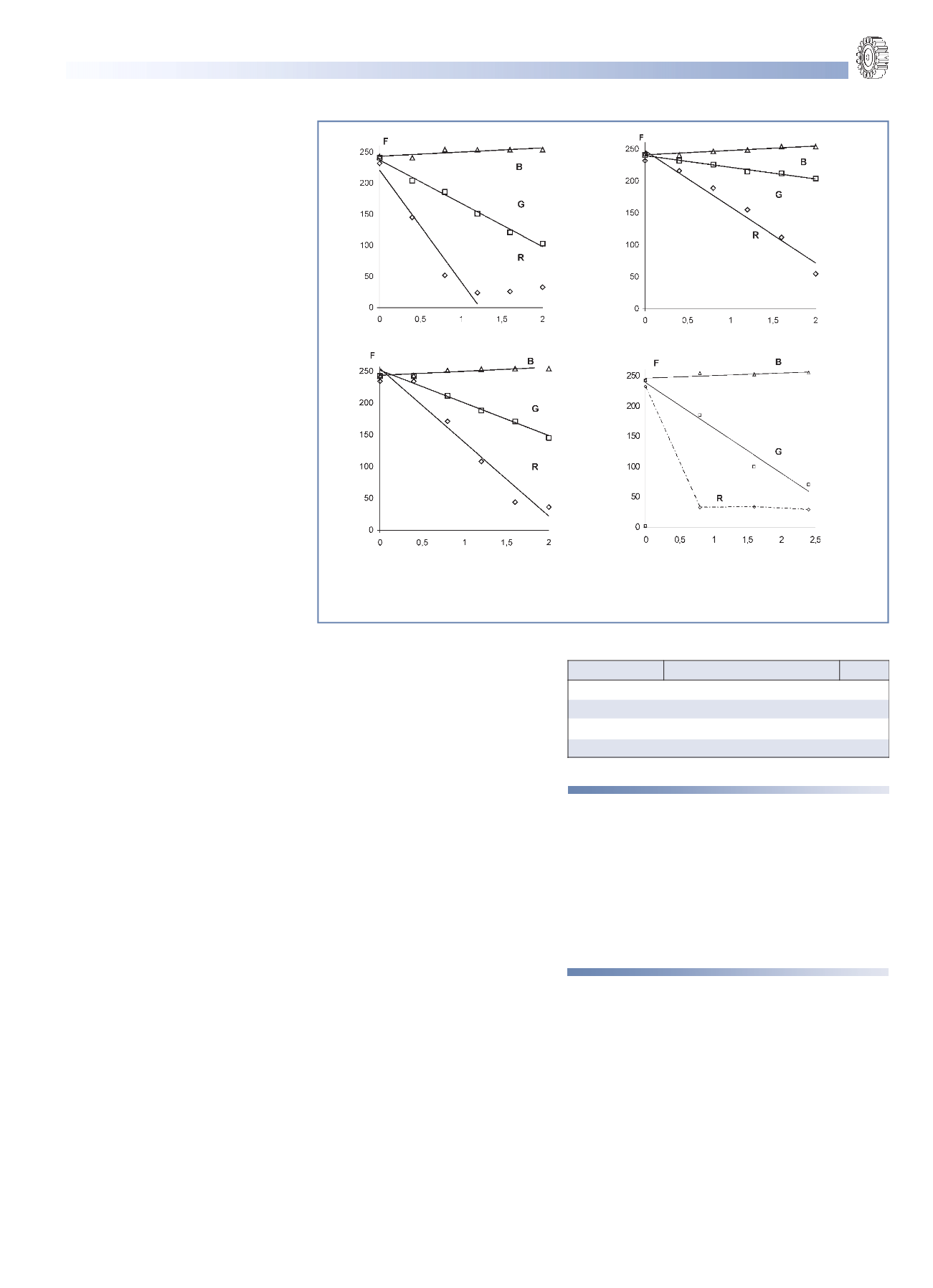
(рис. 1).
На параметры цветности опреде%
ленное влияние оказывает строение
аминокислоты. Градуировки для
разных образцов имеют отличающи%
еся величины эмпирических коэф%
фициентов, а для растворов фенила%
ланина цветная реакция с ионами
меди вообще дает лишь слабое си%
нее окрашивание, слабо зависящее
от концентрации. Для этой амино%
кислоты данная цветная реакция не
может быть использована в качестве
количественного аналитического
сигнала (по%видимому, фенильный
радикал препятствует образованию
стабильного хелатного комплекса).
В зависимости от цвета анализиру%
емого раствора и результатов пост%
роения градуировочных графиков
предпочтение отдается калибровке
по синей (В), зеленой (G) или крас%
ной (R) компоненте. В нашем случае
для определения концентрации ами%
нокислот с помощью цветных реак%
ций с ионами Cu
2+
наиболее подхо%
дящей для градуировки является зе%
леная компонента (G). В табл.1 пока%
заны градуировочные зависимости
величины F зеленой компоненты
цветности (G) концентрации от С для
водных растворов аминокислот (ди%
апазон линейности 0–2 г/л), n=4–6,
P=0,95.
Сопоставим метрологические па%
раметры определений методом цве%
тометрии и фотоколориметрии.
Пробоподготовка для этих методов
идентична, поэтому измерения про%
водили параллельно.
Полученный прозрачный фильтрат
фотометрировали при l=640 нм в
кюветах толщиной 30 мм. Контро%
лем служила дистиллированная
вода. Определения проводили на
приборе КФК%3. На рис. 2 показана
зависимость оптической плотности
от концентрации растворов глицина,
β
%аланина, изолейцина и глицилгли%
цина, в табл. 2 – градуировочные за%
висимости оптической плотности ра%
створов D от концентрации С амино%
кислот (диапазон линейности 0–1,8
г/л), n=4–6, P=0,95. Из полученных
зависимостей видно, что при кон%
центрациях изученных веществ выше
1,2–1,6 г/л оптическая плотность ра%
створов D>1, что ограничивает при%
менение метода фотометрии.
Параллельные опыты по количе%
ственному определению аминокис%
Таблица 1
овтсещеВ
кифаргйынчовориударГ
R
ницилГ
С)3,3±6,96(–)9,3±2,732(=y
6599,0
β
нинала%
С)1,1±3,81(–)3,1±0,042(=y
1399,0
ницйелозИ
С)5,4±5,15(–)5,5±3,152(=y
7489,0
ницилглицилГ
С)4,9±9,47(–)0,41±6,732(=y
7489,0
Преимущества применения
цветометрии на базе цифровых
технологий: экономичность,
возможность сохранить первичную
информацию в электронном виде и
контролировать концентрированные
растворы анализируемых образцов.
Рис. 1. Градуировочные графики зависимости компонент цветности от концентрации водных
растворов: глицина (а);
β
%аланина (б); изолейцина (в); глицилглицина (г), где R – красная, G –
зеленая, B – синяя компонента
г
а
б
в
С, г/л
С, г/л
С, г/л
С, г/л
Электр нная Научная СельскоХозяйственная Библиотека









