Как видно из табл, 11, в случае подкисления для получения изо-
электрического осадка нужны значительно большие количества кремне-
кислоты; изоэлектрический осадок здесь имеет соотношение S i 0
2
: R
2
0
3
,
равное 6,66. Это объясняется тем, что в кислой реакции кремнекислота
имеет низкий потенциал, и ее нужно много для того, чтобы нейтрали-
зовать высокий в кислой среде положительный заряд.
В таблице 12 дан опыт получения изоэлектрического осадка в ще-
лочной среде.
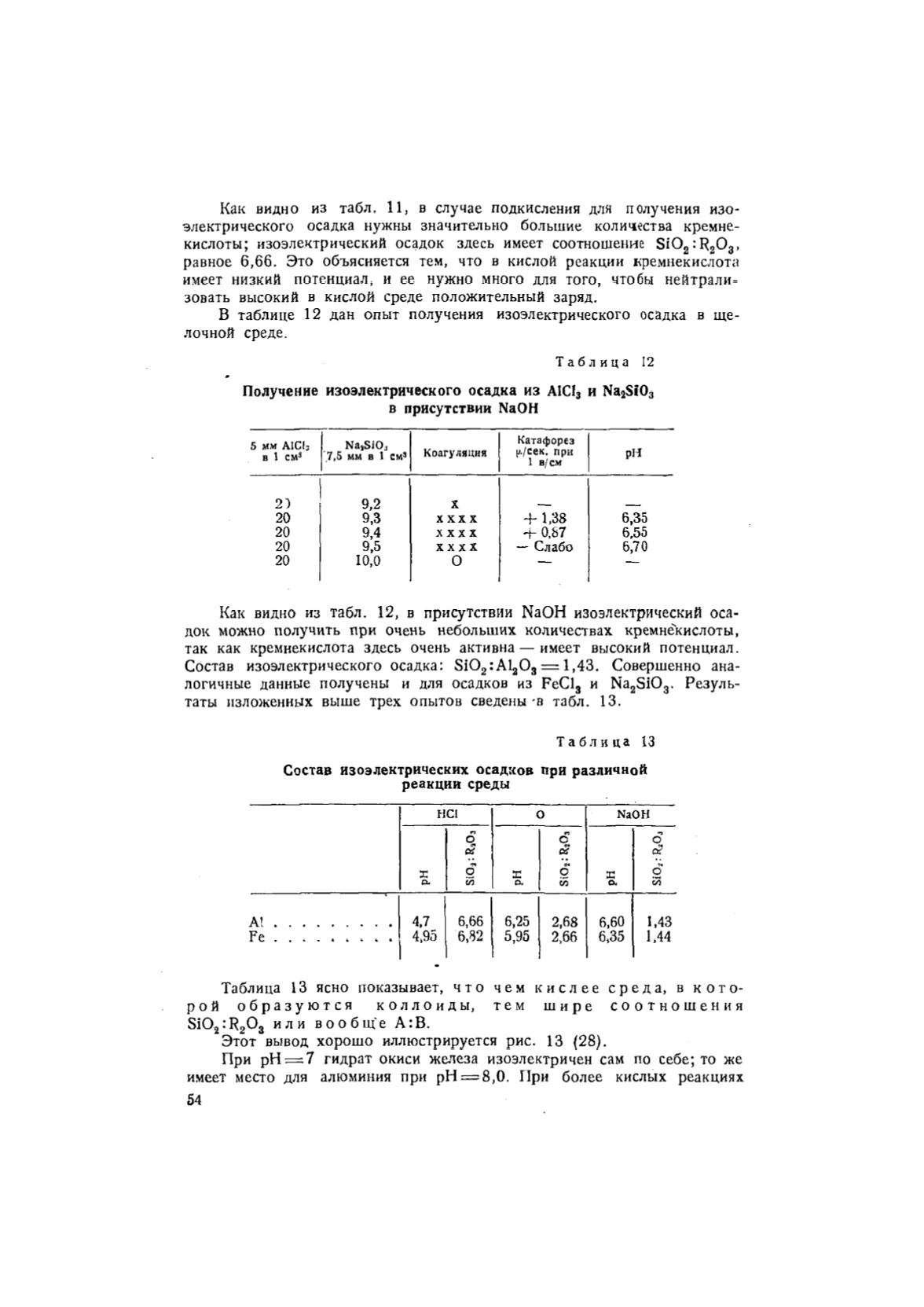
Т а б л и ц а 12
Получение изоэлектрического осадка из А1С1
3
и Na
2
Sf0
3
в присутствии NaOH
5 мм А1С1
3
в 1 см
3
Na
s
SiOj
7,5 мм в 1 см
3
Коагуляция
Катафорез
у./сек. при
1 в/см
РН
2 )
9 , 2
X
2 0
9 , 3
X XX X
+ 1 , 38
6 , 3 5
2 0
9 , 4
X X X X
+ 0 , 87
6 , 55
2 0
9 , 5
X X X X
— Слабо
6 , 70
2 0
1 0 , 0
О
• —
—
Как видно из табл. 12, в присутствии NaOH изоэлектрический оса-
док можно получить при очень небольших количествах кремнекислоты,
так как кремнекислота здесь очень активна — имеет высокий потенциал.
Состав изоэлектрического осадка: S i 0
2
:А1
2
0
3
= 1,43. Совершенно ана-
логичные данные получены и для осадков из FeCl
3
и Na
2
S i 0
3
. Резуль-
таты изложенных выше трех опытов сведены-в табл. 13.
Т а б л и ц а 13
Состав изоэлектрических осадков при различной
реакции среды
HCI
о
NaOH
п
О
« о
-э
о
С*
or
X
ГЯ
О
X
CI
о
£
•я
О
Си
(Л
Си
С/3
ех
со
А!
4.7
6,66
6,25
2,68
6,60
1,43
Fe
4,95
6,82
5,95
2,66
6,35
1,44
Таблица 13 ясно показывает, ч т о ч ем к и с л е е с р е д а , в к о т о -
р о й
о б р а з у ю т с я
к о л л о и д ы ,
т е м
ш и р е
с о о т н о ш е н и я
S i 0
2
: R
2
0
3
и л и в о о б щ е А:В.
Этот вывод хорошо иллюстрируется рис. 13 (28).
При рН = 7 гидрат окиси железа изоэлектричен сам по себе; то же
имеет место для алюминия при рН = 8,0. При более кислых реакциях
54
Электронная книга СКБ ГНУ Россельхзакадемии


